摘要:帕金森病(PD)的干細胞替代療法雖前景廣闊,但移植后多巴胺能(DA)神經元極低的存活率(>90%的丟失)嚴重阻礙其療效。本文聚焦于這一核心挑戰,綜述了近期突破性研究揭示的細胞死亡關鍵機制——TNFα-NFκB-p53信號軸,并提出了兩項核心解決方案:
- 1)短期使用臨床批準的TNFα抑制劑(如阿達木單抗)?以阻斷該死亡通路;
- 2)利用特定細胞表面標志物(CD49e^low/CD184^high)進行無基因工程化的DA神經元純化,以消除非目標細胞帶來的風險。
這兩大策略相輔相成,為提升移植細胞存活率、推動PD細胞療法走向安全有效的臨床轉化提供了明確路徑。
干細胞治療帕金森病:提高人干細胞源多巴胺能神經元存活率的兩種方法
帕金森病(PD)作為第二常見的神經退行性疾病,其核心病理特征是中腦黑質多巴胺(DA)能神經元的進行性退化,導致運動功能嚴重受損。現有藥物如左旋多巴僅能對癥治療,無法逆轉疾病進程。基于人多能干細胞(hPSC,包括胚胎干細胞和誘導多能干細胞)的細胞替代療法,旨在通過移植新的DA神經元從根本上恢復神經環路功能,被視為極具前景的治愈性策略,并已進入臨床試驗階段。
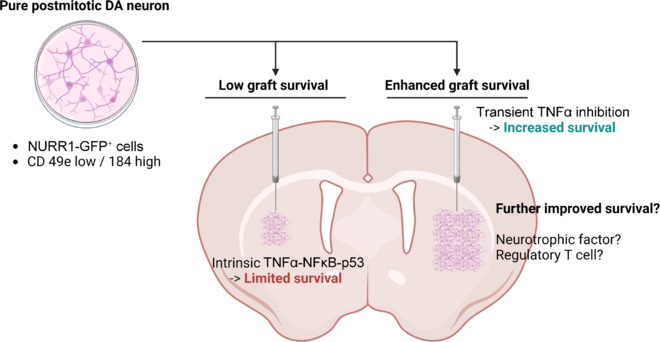
然而,該療法的轉化面臨嚴峻挑戰。其中最突出的是移植后DA神經元的存活率極低,超過90%的細胞在移植后死亡,導致療效不穩定且不可預測。同時,移植產物中混雜的非DA細胞(如血清素能神經元)可能引發移植物誘導的運動障礙等副作用。因此,如何提高移植DA神經元的存活率并確保產物純度,成為領域內亟待解決的核心科學問題。

核心挑戰剖析:移植神經元為何大量死亡?
近期研究為揭示細胞死亡機制帶來了突破。Kim等人(2024)利用體內CRISPR-Cas9篩選技術發現,腫瘤抑制蛋白p53是限制移植后DA神經元存活的關鍵因子(圖1)。這一發現與PD病理中p53水平升高的現象相吻合。進一步研究發現,在移植早期,腫瘤壞死因子-α(TNFα)?通過激活核因子κB(NFκB)信號,進而上調并激活p53,最終啟動DA神經元的程序性死亡。值得注意的是,這種TNFα不僅來源于宿主免疫反應,移植的DA神經元自身也會表達TNFα,形成一種自我限制的“細胞自主性死亡”環路。
解決方案一:靶向死亡通路——短暫抑制TNFα信號
既然TNFα-NFκB-p53軸是導致死亡的關鍵通路,抑制該通路就成為提高存活率的直接策略。研究表明,在移植后關鍵窗口期,短期使用臨床已廣泛應用的TNFα抑制劑(如阿達木單抗),能顯著提高臨床前動物模型中移植DA神經元的存活率,并伴隨運動功能的改善。
此策略的優勢在于:
- 1)轉化速度快:阿達木單抗等藥物安全性已知,“老藥新用”可大幅縮短研發周期;
- 2)治療窗口明確:僅在移植前后短期給藥,即可有效阻斷早期死亡潮,避免長期免疫抑制的潛在風險。
解決方案二:優化移植細胞產品——無基因標記的DA神經元純化
提高存活率不僅需要“救活”細胞,還需從源頭優化移植細胞本身。傳統依賴遺傳報告基因(如NURR1-GFP)的純化方法因涉及基因工程而不適于臨床。為解決此問題,研究者通過篩選鑒定出一組細胞表面標志物組合:CD49e (低表達) 和 CD184 (高表達)。利用流式細胞術分選該標志物陽性的細胞,即可在不進行基因改造的前提下,高效富集到高純度的、有絲分裂后的DA神經元。
這一純化策略的意義重大:
- 1)臨床兼容性好:適用于任何hPSC/iPSC系,為自體或異體治療提供了通用方案;
- 2)提升安全性與療效:去除非目標細胞,降低了運動障礙等副作用風險,并可能富集對PD治療至關重要的、易受損的A9亞型DA神經元;
- 3)保證產品一致性:為標準化細胞制劑生產奠定了基礎。
臨床轉化前景與綜合應用
將上述兩大策略——圍移植期短期TNFα抑制與移植前基于表面標志物的DA神經元純化——相結合,構成了一個協同增強的解決方案。前者為移植細胞創造了初始生存窗口,后者則提供了最優化的“種子”細胞。
這一策略的價值不僅限于PD。TNFα介導的炎癥性死亡是許多細胞移植面臨的共性障礙,因此該方案為其他疾病的細胞治療(如視網膜細胞治療黃斑變性、胰島細胞治療糖尿病)提供了重要參考。此外,流行病學數據提示,長期使用TNFα抑制劑的患者PD發病率降低,暗示該策略可能對原生神經元也有保護作用,或有利于移植物的長期整合。
未來展望與待解問題
盡管前景光明,仍有諸多問題有待探索:
首先,TNFα抑制僅解決了約30%的細胞死亡,其余死亡機制(如移植過程中的缺氧應激)需要進一步闡明。
其次,需要優化TNFα抑制劑的最佳給藥方案(時機、劑量、療程)。
最后,探索將上述策略與神經營養因子輸送、或與具有免疫調節功能的細胞(如調節性T細胞)共移植等聯合方案,有望進一步優化移植微環境,實現存活率的階梯式提升。
結論
綜上所述,通過精準解析移植后DA神經元死亡的核心通路(TNFα-NFκB-p53軸),并據此開發出藥理學干預與細胞產品工程化的雙軌策略,我們為突破帕金森病干細胞療法存活率低的瓶頸提供了清晰、可轉化的路徑。這些進展不僅推動了PD細胞治療向臨床現實邁進,也為整個細胞替代治療領域樹立了攻克移植存活難題的典范。
參考資料:
Gantner CW, de Luzy IR, Kauhausen JA, Moriarty N, Niclis JC, Bye CR, Penna V, Hunt CPJ, Ermine CM, Pouton CW, Kirik D, Thompson LH, Parish CL (2020) Viral delivery of GDNF promotes functional integration of human stem cell grafts in Parkinson’s disease. Cell Stem Cell 26:511–526.
Kamath T, Abdulraouf A, Burris SJ, Langlieb J, Gazestani V, Nadaf NM, Balderrama K, Vanderburg C, Macosko EZ (2022) Single-cell genomic profiling of human dopamine neurons identifies a population that selectively degenerates in Parkinson’s disease. Nat Neurosci 25:588–595.
Kikuchi T, Morizane A, Doi D, Magotani H, Onoe H, Hayashi T, Mizuma H, Takara S, Takahashi R, Inoue H, Morita S, Yamamoto M, Okita K, Nakagawa M, Parmar M, Takahashi J (2017) Human iPS cell-derived dopaminergic neurons function in a primate Parkinson’s disease model. Nature 548:592–596.
Kim TW, Koo SY, Studer L (2020) Pluripotent stem cell therapies for Parkinson disease: present challenges and future opportunities. Front Cell Dev Biol 8:729.
Kim TW, Piao J, Koo SY, Kriks S, Chung SY, Betel D, Socci ND, Choi SJ, Zabierowski S, Dubose BN, Hill EJ, Mosharov EV, Irion S, Tomishima MJ, Tabar V, Studer L (2021) Biphasic activation of WNT signaling facilitates the derivation of midbrain dopamine neurons from hESCs for translational use. Cell Stem Cell 28:343–355.
Kim TW, Koo SY, Riessland M, Chaudhry F, Kolisnyk B, Cho HS, Russo MV, Saurat N, Mehta S, Garippa R, Betel D, Studer L (2024) TNF-NF-kappaB-p53 axis restricts in vivo survival of hPSC-derived dopamine neurons. Cell 187:3671–3689.
Kirkeby A, et al. (2023) Preclinical quality, safety, and efficacy of a human embryonic stem cell-derived product for the treatment of Parkinson’s disease, STEM–PD. Cell Stem Cell 30:1299–1314.
Park S, Kim J, Chun J, Han K, Soh H, Kang EA, Lee HJ, Im JP, Kim JS (2019) Patients with inflammatory Bowel disease are at an increased risk of Parkinson’s disease: a South Korean nationwide population-based study. J Clin Med 8:1191.
Park TY, Jeon J, Lee N, Kim J, Song B, Kim JH, Lee SK, Liu D, Cha Y, Kim M, Leblanc P, Herrington TM, Carter BS, Schweitzer JS, Kim KS (2023) Co-transplantation of autologous T(reg) cells in a cell therapy for Parkinson’s disease. Nature 619:606–615.
Peter I, Dubinsky M, Bressman S, Park A, Lu C, Chen N, Wang A (2018) Anti-tumor necrosis factor therapy and incidence of Parkinson disease among patients with inflammatory bowel disease. JAMA Neurol 75:939–946.
Poewe W, Seppi K, Tanner CM, Halliday GM, Brundin P, Volkmann J, Schrag AE, Lang AE (2017) Parkinson disease. Nat Rev Dis Primers 3:17013.
Probert L (2015) TNF and its receptors in the CNS: the essential, the desirable and the deleterious effects. Neuroscience 302:2–22.
Schweitzer JS, et al. (2020) Personalized iPSC-derived dopamine progenitor cells for Parkinson’s disease. N Engl J Med 382:1926–1932.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信